近日,我校化学与生物学交叉研究中心王安辉和李国辉教授团队与中国科学院分子细胞卓越中心赵祥研究员等合作,在机械感受受体功能调控及肿瘤免疫治疗研究方面取得重要突破。该工作是李国辉团队继2016年《Nature》、2018年《Science》和2019年《Nature》之后在生物体系理论计算模拟研究方面取得的又一重要成果。
相关研究成果以“Tuning the sensitivity of mechanosensory receptors through histidine scanning”为题,发表在国际顶级学术期刊《细胞》(Cell)上。该工作由我校作为共同第一作者和共同通讯作者单位(排名第二)完成,是我校以共同通讯单位在Cell期刊发表的首篇研究论文,标志着学校在化学与生物学前沿交叉领域取得了突破性进展。

T细胞受体(TCR)是一类典型的机械感受受体,在免疫系统中通过感知并响应抗原肽-主要组织相容性复合体(pMHC)所施加的机械力,触发细胞内信号转导。基于TCR的TCR-T细胞治疗在实体瘤治疗中展现出重要应用前景,但如何获得兼具高功能效力与高度安全性的TCR,一直是该领域面临的核心挑战。传统的亲和力成熟策略通常通过提高结合亲和力增强TCR功能,却可能引发严重的脱靶毒性或“靶向非肿瘤组织”毒性,限制了其临床应用。
本研究聚焦于TCR作为机械感受受体的独特生物物理特性,提出并系统验证了一种全新的通用策略——组氨酸扫描(histidine scanning)。实验合作者发现,通过在TCR的互补决定区(CDR)中引入单点组氨酸突变,可高效识别一组关键“热点”位点,这些位点能够促进 TCR 与 pMHC 在受力条件下形成逆锁键(catch bond),从而显著增强 TCR 的力学信号转导能力和整体功能效力。进一步地,这些热点位点可用于构建 TCR 文库,从中筛选获得低亲和力但高效力的 TCR 突变体,在保持强抗肿瘤活性的同时,有效避免脱靶毒性和靶向非肿瘤组织毒性。
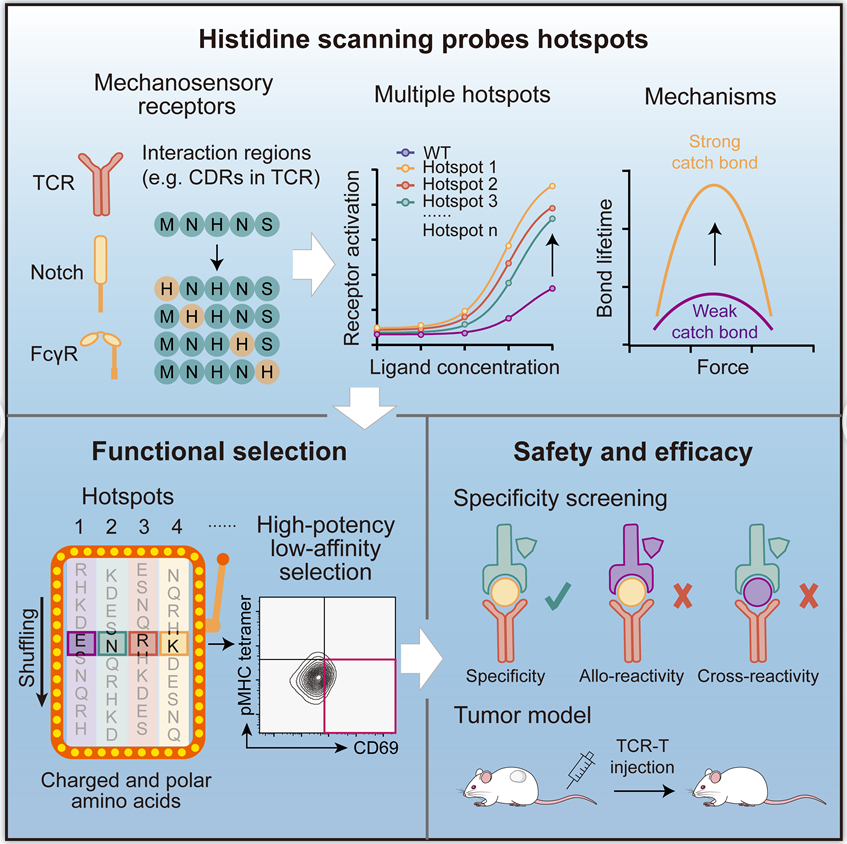
全新的TCR突变体筛选通用策略——组氨酸扫描流程
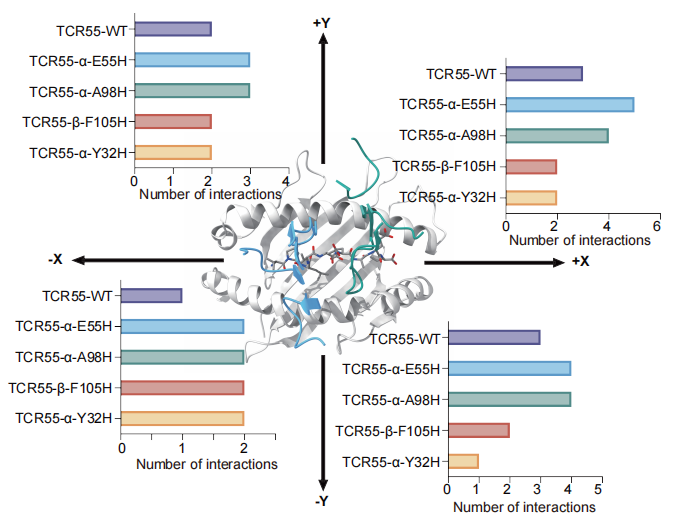
理论计算预测的不同剪切方向的强逆锁键强度
基于上述实验发现,化学与生物学交叉研究中心团队通过理论计算,利用分子动力学模拟及相互作用统计分析,从原子水平揭示了组氨酸突变体在受力剪切过程中如何促进新的氢键和盐桥形成,重塑 TCR-pMHC 界面的瞬时相互作用网络,从而增强逆锁键强度。理论计算结果进一步表明,逆锁键形成能力与 TCR 突变体信号强度及功能效力具有显著相关性。这些计算结果为实验观测到的 TCR 功能增强提供了清晰的分子机制解释,充分体现了化学与生物学深度交叉融合的研究特色,为安全有效的 TCR-T 细胞治疗提供了重要的理论支撑。
化学与生物学交叉研究中心王安辉教授为论文共同第一作者,李国辉教授为共同通讯作者。该工作得到国家自然科学基金、兴辽英才计划及辽宁师范大学科研启动资金的支持。
论文链接:https://doi.org/10.1016/j.cell.2025.12.050
文字:王安辉
编辑:王安辉
审核:李国辉

